La nature, source d’inspiration
Q’une molécule provienne d’un laboratoire de synthèse ou qu’elle soit extraite d’une fleur d’Indonésie, elle reste avant tout une molécule sous l’oeil du chimiste! Mais la diversité et la complexité des molécules «naturelles» rendent parfois bien des services aux chimistes qui orchestrent des synthèses complexes.
Depuis que l’homme est homme, il a su puiser dans la nature de quoi se soigner. Dans la pharmacopée moderne, deux tiers des principes actifs des médicaments ont été trouvés dans les végétaux, même si bien souvent leur synthèse a ensuite été mise au point dans les laboratoires de chimie organique pour éviter d’avoir à piller le milieu naturel. Ne citons que quelques exemples : la morphine extraite du pavot, l’aspirine du saule, la digitaline issue des digitales pourpres et utilisée pour traiter les insuffisances cardiaques, deux anticancéreux très utilisés – la vinblastine et le taxol – extraits respectivement de la pervenche de Madagascar (photo) et d’une espèce bien particulière d’if. Les microorganismes ne sont pas en reste qui fournissent de nombreux antibiotiques : du champignon Penicillium notatum, dont la toxine « pénicilline » fut le premier antibiotique, aux Streptomyces qui ont permis de générer 3 000 produits actifs (antibiotiques mais aussi anticancéreux, herbicides…) et on estime à 100 000 le nombre restant à découvrir ! Le milieu marin, quant à lui, semble être le champ idéal de nombreuses découvertes futures (donnons l’exemple de l’AZT, antirétroviral utilisé contre le SIDA, qui a été trouvé dans le sperme de hareng). Mais désormais, le chimiste ne se contente plus d’imiter les molécules issues de la biodiversité, il les apprivoise pour qu’elles l’assistent dans ses tâches quotidiennes !
Le chimiste est pressé !
Un des paramètres important pour le chimiste est le temps que va mettre une réaction pour se dérouler. Il utilise pour quantifier ce paramètre une mesure appelée « temps de demi-vie » qui définit le temps au bout duquel la moitié des produits de départ a été consommée pour donner les produits d’arrivée. Par exemple, une fonction amide (figure 1) (qui existe dans les matériaux synthétiques comme le polyamide ou bien dans les protéines) peut être hydrolysée (réagir avec l’eau) pour donner un acide et une amine. Le temps de demi-vie dans l’eau à 20 °C est 7 ans ! En chauffant à 100 °C, grand classique du chimiste qui veut accélérer une réaction, on passe à une dizaine de jours. En rajoutant un catalyseur chimique (10 % d’acide chlorhydrique), nous voici à 1 ou 2 heures. Mais imaginez que l’amide à hydrolyser soit contenue dans une tache de sang ou de jaune d’oeuf sur votre teeshirt préféré. Vous apprécierez alors l’incroyable efficacité de la protéase, une protéine-enzyme des lessives qui à des doses infimes (0,0001%) sera capable de détruire la matière organique. Les biocatalyseurs sont extrêmement efficaces !
Le chimiste est exigeant !
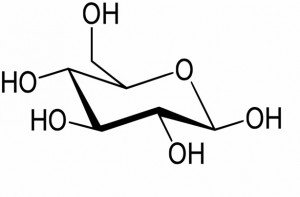
Imaginez une molécule de glucose (figure 2), un sucre simple. Elle possède 4 fonctions OH. Imaginez maintenant que l’on veuille faire une modification spécifique de l’une de ces fonctions OH dans un dérivé du glucose (une estérification en l’occurrence) sans toucher aux autres (réaction dite régiosélective), pourtant quasi-identiques ! Un casse-tête pour un professionnel de la synthèse mais pas pour des enzymes. Selon qu’on utilisera une lipase de Chromobacterium viscosum ou une lipase de Candida rugosa pour catalyser la réaction, le produit final s’en trouvera changé! Purifier une protéine pour l’utiliser seule coûte très cher? Qu’à cela ne tienne, on peut pour certaines réactions utiliser les microorganismes entiers dans un fermenteur. Faire travailler ces petits êtres microscopiques est très peu onéreux ! Une forme encore plus subtile de sélectivité est la stéréosélectivité. Il existe des molécules, et c’est particulièrement vrai dans le monde vivant, qui possèdent deux formes ayant exactement les mêmes atomes et les mêmes liaisons mais qui sont images l’une de l’autre dans un miroir comme le sont notre main droite et notre main gauche. Synthétiser l’une de ces molécules sans synthétiser l’autre constitue le challenge de la synthèse asymétrique, discipline reine à l’ICMMO depuis les travaux pionniers d’Henri Kagan. C’est particulièrement vital pour un médicament, une forme pouvant être active contre une maladie, l’autre toxique. L’asymétrie ne naît pas de la symétrie, il faut l’introduire à un moment ou à un autre de la synthèse, soit dans les molécules de départ ou les intermédiaires, soit dans les catalyseurs. Et là encore les enzymes des micro-organismes, purifiées ou in vivo, font cela très bien ! On les utilise par exemple pour synthétiser des antiviraux comme l’Abacavir ou le Crixivan, utilisés contre le SIDA.
Le chimiste aime bien s’entourer de biologistes !
Pourquoi ces protéines-enzymes sont elles si sélectives ? Parce que dans la nature elles sont « design-ées » justement pour remplir une mission bien précise en raison de leur forme (la façon dont elles se replient). Mais on peut les détourner de leur mission première. Elles savent catalyser des réactions sur des composés qu’elles n’avaient jamais rencontrés avant. Et si elles ne le font pas assez bien au goût du chimiste, il appelle son collègue généticien pour les y aider. En introduisant au hasard des mutations génétiques dans le génome d’un microorganisme, on va produire parfois un micro-organisme qui synthétisera une protéine-enzyme plus efficace. On le sélectionnera alors et provoquera une autre série de mutations dans son génome, qui produira parmi d’autres un individu encore plus efficace, qu’on sélectionnera, etc. jusqu’à obtenir une sélectivité quasi-totale du catalyseur biologique. Dans les années 1980, les chimistes cherchaient des nouveaux catalyseurs dans des milieux riches en micro-organismes comme les boues des stations d’épuration. Aujourd’hui, c’est davantage dans les éprouvettes que le chimiste crée la biodiversité dont il a besoin.
Contact
Michel Thérisod
UFR SCIENCES
ICMMO (Institut de Chimie Moléculaire et des Matériaux d’Orsay)
Email : michel.therisod@u-psud.fr
Tel : 01 469 15 63 11


Laissez un commentaire